Để giúp các bạn học sinh hiểu rõ phản ứng nhiệt nhôm là gì? Bài viết ngày hôm nay, sieusach.info sẽ tổng hợp đầy đủ những thông tin về phản ứng nhiệt nhôm để gửi đến các bạn! Hãy cùng theo dõi nào!
Nội dung chính
Phản ứng nhiệt nhôm là gì?
Phản ứng nhiệt nhôm là một loại phản ứng ở nhiệt độ cao giữa kim loại nhôm với oxit hoặc với các chất khác. Có vai trò là chất khử, phản ứng này sinh nhiều nhiệt và tạo ra nhiều đơn chất kim loại khác.

Tìm hiểu về phản ứng nhiệt nhôm
Ta cùng tìm hiểu phản ứng nhiệt nhôm qua phương trình giữa nhôm với các axit như sau:
Nhôm khi phản ứng oxit sắt: 2yAl + 3FexOy → yAl2O3 + 3xFe
Đây là loại phản ứng đặc trưng và có nhiều ứng dụng nhất. Cụ thể là hỗn hợp tạo thành gồm có Fe và Al2O3 dùng để hàn vá đường ray tàu lửa.
Phản ứng nhiệt nhôm sinh ra kim loại nào?
Khi phản ứng nhiệt nhôm xảy ra, nhôm sẽ đẩy các kim loại khác ra khỏi oxit phải thõa mãn điều kiện: Đó phải là những kim loại trung bình hoặc yếu (từ Zn trở đi). Bạn hoàn toàn có thể dùng dãy hoạt động hóa học để tìm hiểu thêm các kim loại này nếu vẫn chưa nhớ.
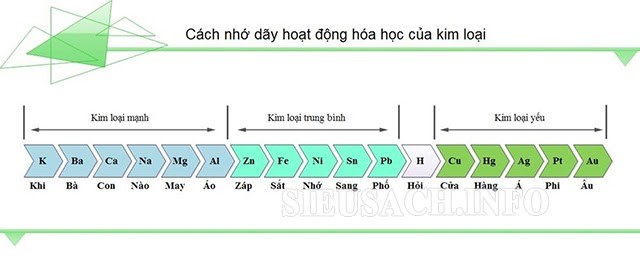
Dãy hoạt động hóa học kim loại để bạn tham khảo thêm
Lưu ý khi giải bài tập hiệu suất phản ứng nhiệt nhôm
Khi tiến hành giải bài tập này, các bạn học sinh cần phải lưu ý một số điểm quan trọng dưới đây:
- Nếu hỗn hợp sau khi phản ứng cho tác dụng với dung dịch kiềm có sinh ra khí H2 thì Al còn dư sau phản ứng nhiệt nhôm hoặc hiệu suất H của phản ứng bé hơn 100%. Phản ứng này liên quan đến tính chất của kim loại Al nên các bạn học sinh cần phải nắm vững.
- Khi kết thúc phản ứng mà không thấy khí bay lên thì nghĩa là Al không dư và phản ứng thì xảy ra hoàn toàn
- Theo định luật bảo toàn khối lượng, tổng khối lượng hỗn hợp trước phản ứng = tổng khối lượng hỗn hợp sau khi phản ứng.

Một số lưu ý khi giải bài tập về phản ứng nhiệt nhôm
- Nhớ áp dụng định luật bảo toàn electron khi giải bài tập.
- Giả thiết cho phản ứng xảy ra hoàn toàn → Thì chất rắn chắc chắn có Al2O3, Fe hoặc có thể có Al, FexOy dư. Còn nếu giả thiết không nói đến hoàn toàn, hoặc bắt tính hiệu xuất thì các bạn nên nhớ đến trường hợp chất rắn sau phản ứng có cả 4 chất gồm: Al, FexOy, Al2O3, Fe.
Bài tập về hiệu suất phản ứng nhiệt nhôm có lời giải
Một số bài tập về phản ứng hiệu suất nhiệt nhôm
Bài số 1:
Đề bài
Khi cho 41,4 gam hỗn hợp X gồm có Fe2O3, Cr2O3 và Al2O3 tác dụng với dung dịch NaOH đặc (dư). Sau khi phản ứng thu được chất rắn có khối lượng là 16 gam. Để khử hoàn toàn 41,4g X bằng phản ứng nhiệt nhôm, cần dùng 10,8 gam Al. Thành phần phần trăm theo khối lượng của Cr2O3 có trong hỗn hợp X là? (Cho biết: hiệu suất của các phản ứng là 100%; O = 16; Al = 27; Cr = 52; Fe = 56)
- 50,67%.
- 20,33%.
- 66,67%.
- 36,71%.
 Bài tập số 1
Bài tập số 1Lời giải
Khi cho hỗn hợp X tác dụng với NaOH ta thu được các phương trình hóa học sau đây:
PTHH: Cr2O3 + 2NaOH → 2NaCrO2+ H2O
PTHH: Al2O3 + 2NaOH → 2NaAlO2 + H2O
Vì Fe2O3 không phản ứng được với dung dịch kiềm, nên khối lượng chất rắn còn lại là Fe2O3
mFe2O3 = 16 gam.
Từ đó tính được số mol của oxit sắt III là: → n Fe2O3 = 16/160 = 0,1 mol
Tiến hành phản ứng nhiệt nhôm của X:
PTHH: Cr2O3 + 2Al → Al2O3 + 2Cr (1)
PTHH: Fe2O3 + 2Al → Al2O3 + 2Fe (2)
0,1 mol
Theo bài ra ta có số mol Al cần phản ứng sẽ bằng: nAl = 10.8/27 = 0.4 (mol)
Theo phương trình (2) khi cân bằng số mol thì nAl = 2.nFe3O4 = 0,2 (mol)
Do đó, số mol còn lại của Al có trong phương trình (1) là:
nAl (1) = 0.4 – 0.2 = 0.2 (mol)
Dễ dàng suy ra:
nCr2O3 = 0.1 mol ——> m = 15.2 gam
Phần trăm oxit crom trong hỗn hợp bằng: % Cr2O3 = 15.2 / 41.4 = 36.71 % —-> Chọn đáp án trắc nghiệm là D.
Bài số 2:
Đề bài
Nung nóng m gam hỗn hợp Al và Fe2O3 (ở trong môi trường không có không khí) tới khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Rồi chia Y thành hai phần bằng nhau:
– Phần 1 cho tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc);
– Phần 2 cho tác dụng với dung dịch bazo NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc).
Giá trị của m là
- 22,75
- 21,40.
- 29,40.
- 29,43.
Lời giải
Đầu tiên ta xác định được ngay là dạng toán liên quan đến phản ứng nhiệt nhôm giữa Al và oxit sắt II. Phương trình phản ứng:
PTHH: 2Al + Fe2O3 —-> Al2O3 + 2Fe (1)
Phần 2 tác dụng với dung dịch bazo NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc):
Al + NaOH + H2O NaAlO2 + 3/2H2
Phần (1) tác dụng với dung dịch H2SO4 ta được các phương trình sau:
PTHH: 2Al + 3H2SO4 ————-> Al2(SO4)3 + 3H2
=>nAl= 0.025(mol)
Fe + H2SO4 l ——————-> FeSO4 + H2
y = 0.1 mol
2Al + Fe2O3 —————-> Al2O3 + 2Fe (1)
Khối lượng của Al : m (Al) = (0,1 +0,025).27 = 3,375(gam)
Khối lượng của Fe2O3 : m(Fe2O3) = 0,05.160 = 8(gam)
Suy ra tổng khối lượng của chất rắn: m = 11,375.2 = 22,75 (gam)
Vậy đáp án đúng của bài tập này là đáp án A. 22,75 gam
Bài tập trắc nghiệm về phản ứng nhiệt nhôm ( có lời giải)
Bài 1: Đốt nóng hỗn hợp X gồm Fe2O3 và bột Al trong môi trường không có không khí. Nếu cho những chất còn lại sau phản ứng tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2; còn nếu cho tác dụng với dung dịch HCl dư thu được 0,4 mol H2. Vậy số mol Al trong hỗn hợp X là:
- 0,3
- 0,4
- 0,25
- 0,6
Lời giải:
Đáp án: A
Khi cho Al phản ứng với NaOH hoặc HCl thì số mol H2 thu được là như nhau:
nH2 = 0,3 mol ⇒ nAl = 0,2 mol
Từ đó suy ra nH2 do Fe tạo ra = 0,4 – 0,3 = 0,1 mol
nFe = 0,1 mol ⇒ nAl đã phản ứng tạo Fe là 0,1 mol vì:
Fe2O3 + 2Al → Al2O3 + 2Fe
∑nAl = 0,1 +0,2 = 0,3 mol
Bài 2: Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
- Al2O3và Fe
- Al, Fe và Al2O3
- Al, Fe, Fe3O4và Al2O3
- Al2O3, Fe và Fe3O4
Đáp án: B
8Al + Fe3O4 −tº→ 4Al2O3↓ + 9Fe
⇒ nFe3O4/nAl = 3/8 < 1/3 ⇒ Al còn Fe3O4 hết
⇒ Hỗn hợp sản phẩm gồm Al2O3, Fe và Al (dư)
Bài 3: Nung hỗn hợp gồm 10,8 gam gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại M trong Y là:
- 5,6 gam
- 22,4 gam
- 11,2 gam
- 16,6 gam
Đáp án: D Vì:
PTPU: Fe2O3 + 2Al → Al2O3 + 2Fe
0,1 mol 0,2mol 0,2 mol
⇒ Khối lượng Y = mFe + mAl dư
= 56.0,2 + (10,8 – 27.0,2) = 16,6 g
Bài 4: Trộn 10,8 g bột Al với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 10,752 lít khí H2 (đktc). Hiệu suất của phản ứng nhiêt nhôm là
- 80%
- 90%
- 70%
- 60%
Đáp án: A
Ta có : nAl = 10,8 / 27 = 0,4 mol ;
nFe3O4 = 34,8 / 232 = 0,15 mol
nH2 = 10,752 / 22,4 = 0,48 mol
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒ hỗn hợp chất rắn Al dư, Fe3O4 dư , Al2O3 và Fe.
Theo phản ứng :
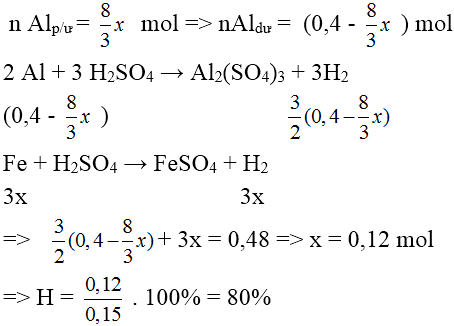
Bài 5: Trộn 8,1 (g) bột Al với 48g bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí, kết thúc thí nghiệm lượng chất rắn thu được là:
- 61,5 g
- 56,1 g
- 65,1g
- 51,6 g
Đáp án: B
Áp dụng định luật bảo toàn khối lượng ta có :
mc.rắn = mAl + mFe2O3 = 8,1 + 48 = 56,1 g
Bài 6: Trộn 5,4 gam bột Al với 17,4 gam bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm (trong điều kiện không có không khí). Giả sử chỉ xảy ra phản ứng khử Fe3O4 thành Fe. Hòa tan hoàn toàn chất rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 5,376 lít khí H2 (ở đktc). Hiệu suất phản ứng nhiệt nhôm và số mol H2SO4 đã phản ứng là:
- 75 % và 0,54 mol
- 80 % và 0,52 mol
- 75 % và 0,52 mol
- 80 % và 0,54 mol
Đáp án: D
nAl = 0,2 mol ; nFe3O4 = 0,075 mol ; nH2 = 0,24 mol
Phản ứng xảy ra không hoàn toàn:
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
x 0,5x mol
BT e ta có: 2.nFe + 3.nAl = 2.nH2
⇒ 9/8.x.2 + (0,2 – x).3 = 0,24.2 → x = 0,16 mol → Hphản ứng = 0,16/0,2 = 80%
BT e ⇒ nH+phản ứng = 2.nFe + 3.n Al + 6.nAl2O3 + 8.nFe3O4 = 0,36 + 0,12 + 0,48 + 0,12 = 1,08 mol
→ nH2SO4phản ứng = 1,08/2 = 0,54mol
Bài 7: Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
- 60% và 20,40
- 60% và 30,75
- 50% và 20,75
- 50% và 40,80
Đáp án: A
Hỗn hợp X ( Al dư + Fe + Fe2O3 ) →( NaOH dư => Al hết nên Z = Fe + Fe2O3 dư.
nAl dư = 2nH2/ 3 = 0,1 mol
⇒ H = (0,25 – 0,1)/0,25 .100% = 60%
có ptpu: Fe2O3 + 2Al → Al2O3 + 2Fe
0,075 <=0,15
⇒ mZ = m Fe2O3(dư) + m Fe = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g
Bài 8: Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là:
- 45,6 gam
- 57,0 gam
- 48,3 gam
- 36,7 gam
Đáp án: C
nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol
– Hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
PTHH:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3
nH2 = 0,15 mol → y = 0,1 mol
Áp dụng ĐLBT nguyên tố với Al: 2x + y = 0,5 → x = 0,2 mol
Áp dụng ĐLBT nguyên tố với O: nO(Fe3O4) = nO(Al2O3) = 0,2.3 = 0,6 mol
→ nFe3O4 = 0,15mol
Áp dụng nguyên tố với Fe: n =Fe = 3nFe3O4 = 3.0,15 = 0,45 mol
Áp dụng khối lượng: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam
Vừa rồi chúng ta đã tìm hiểu phản ứng nhiệt nhôm là gì và cùng giải một số bài tập liên quan đến hiệu suất phản ứng nhiệt nhôm! Hy vọng những thông tin trên sẽ giúp ích cho các bạn học tốt hơn về bộ môn hóa học! Hẹn gặp lại các bạn trong các bài viết tiếp theo của sieusach.info!
Xem thêm: